医疗器械安全性评价平台
 服务项目
服务项目
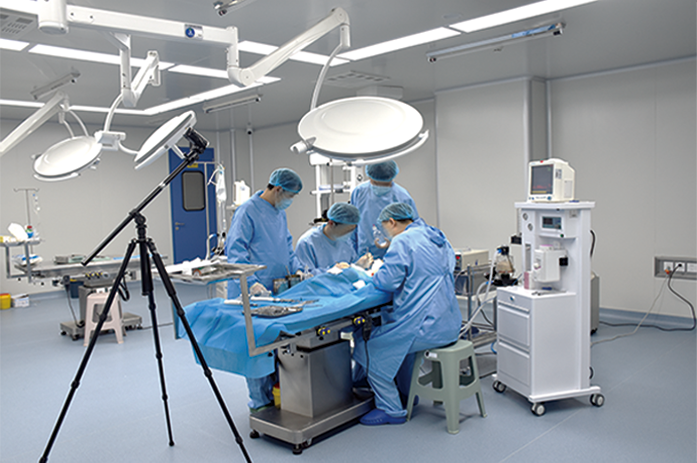
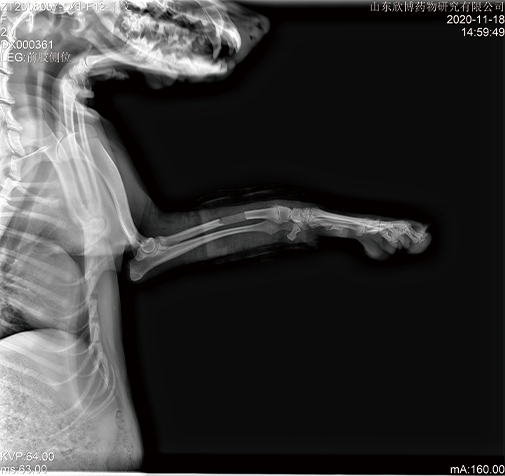
在GLP实验室按照法规要求完成高端医疗器械的非临床动物试验,已完成多个三类医疗器械安全性和有效性的动物试验研究,包括体内止血材料、神经外科止血材料、血管内封堵或止血材料、牙科植入材料、骨科植入材料、新型皮肤缝合材料等,并通过审评。
■ 体外细胞毒性试验
■ 全身毒性试验
■ 植入后局部反应试验
■ 刺激与迟发型超敏反应试验
■ 遗传毒性试验
■ 生殖毒性试验
■ 医疗器械临床前动物安全性与有效性试验
■ 药械组合项目的非临床动物试验
 评价的品种
评价的品种
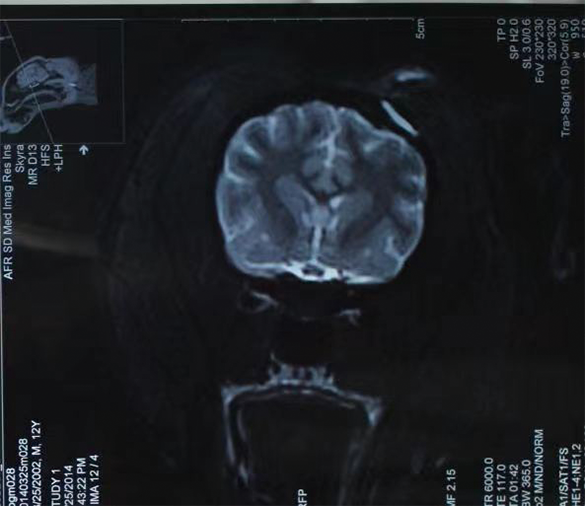
>脑 植 入:可吸收止血纱、可吸收硬脑膜封合医用胶、福爱乐医用胶
>脏器植入:康派特医用胶、美法仑缓释植入剂
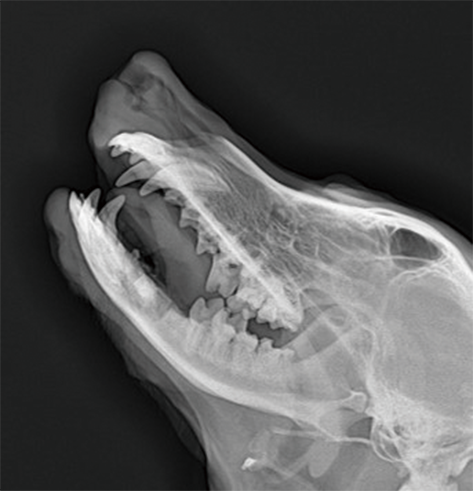
>牙科材料:可注射根填充糊剂、根管填充材
>鼻腔植入:可降解耳鼻止血绵
>肌袋植入:活性生物骨
>皮肤植入:生物羊膜/绒毛膜
>脊柱植入:可吸收止血流体明胶
>皮下植入:硬脑膜医用胶
>脏器植入:康派特医用胶、美法仑缓释植入剂
>牙科材料:可注射根填充糊剂、根管填充材
>鼻腔植入:可降解耳鼻止血绵
>肌袋植入:活性生物骨
>皮肤植入:生物羊膜/绒毛膜
>脊柱植入:可吸收止血流体明胶
>皮下植入:硬脑膜医用胶
 公司业绩-获得临床批件(仅展示部分公司业绩)
公司业绩-获得临床批件(仅展示部分公司业绩)
| 药品名称 | 受理号 | 适应症 | 注册分类 |
| 一次性使用高频切开刀 | 国械注准20233011227 | 本产品与软化消化道内窥镜和高频手术设备配套使用,利用高频电流切开消化道内组织。 | 第三类 |
| 活性生物骨 | 国械注准20223131334 | 用于填充由于创伤或手术造成的、不影响骨结构稳定性的骨缺损。 | 第三类 |
| 医用胶 | 国械注准20213020696 | 用于手术切口接近皮肤表面边缘的封闭,包括微创介入手术穿刺的封闭,完全清创口的封闭,不可用于皮肤亚表层的闭合;在其他无效的情况下,可用于体内直视下或腔镜下清创后创面喷涂,对器官、组织创面渗血的封闭/止血。 | 第三类 |
| 可吸收血管封合医用胶 | 国械注准20193020081 | 用于血管重建时,通过机械封闭方式辅助止血。 | 第三类 |
| 可吸收硬脑膜封合医用胶 | 国械注准20183020031 | 用于开颅手术中,硬脑膜缝合部位的辅助封合,防止脑脊液渗漏。血管重建时,通过机械封闭方式辅助止血。 | 第三类 |
| 组织胶水 | 国械注准20173024576 | 用于胃静脉曲张栓塞的治疗。 | 第三类 |
| 组织粘合胶 | 国械注准20173023182 | 该产品仅供体表局部涂抹使用,仅限于边缘对合良好的手术切口对合后使用,包括微创介入手术穿刺后的伤口、完全清创后的伤口,不可用于体表以下解剖部位,也不能替代皮肤深部缝合。 | 第三类 |
| 医用胶 | 国械注准20153021282 | 用于手术切口接近皮肤表面边缘的封闭,包括微创介入手术穿刺的封闭,完全清创口的封闭,不可用于皮肤亚表层的闭合;在其他无效的情况下,可用于体内直视下或腔镜下清创后创面喷涂,对器官、组织创面渗血的封闭/止血;用于胃静脉曲张的栓塞治疗。 | 第三类 |